Metástase de Ca. de próstata para o acrômio
- 3 de fev. de 2021
- 15 min de leitura
Atualizado: 15 de abr. de 2021
Paciente de 70 anos, do sexo masculino, com dor no ombro. Histórico de tumor de próstata operado há mais de 1 ano. Foi solicitada ressonância magnética (RM) do ombro:

Figura 1 (a-e): Imagens de RM do ombro no plano coronal nas ponderações T1 (1a), T2 (1b), T2 com supressão de gordura (1c) e T1 em fase (1d) e fora de fase (1e). Relação entre as sequências T1 em fase e fora de fase = 0.

Figura 2 (a-c): Imagens de RM do ombro no plano transversal na ponderação T1 com supressão de gordura antes (2a) e após a administração venosa de contraste (2b), com subtração das sequências (2c). Gd - gadolínio.

Figura 3 (a-b): Imagens de RM do ombro no plano sagital na ponderação DP com supressão de gordura (3a) e T1 com supressão de gordura pós-contraste (3b). Gd - gadolínio.

Figura 4 (a-d): Imagens de RM do ombro no plano transversal na ponderação DP com supressão de gordura (4a), ADC (valor = 805) (4b) e difusão com b100 (4c) e b1000 (4d).
Foi solicitado também exame de PET-CT com FDG (18-F fluordeoxiglicose):

Figura 5 (a-b): Imagens de PET-CT FDG nos planos coronal (5a) e transversal (5b).
O paciente foi submetido a radioterapia (RT), com exame de controle 5 meses depois:

Figura 6 (a-e): Imagens de RM do ombro no plano coronal nas ponderações T2 (6a), STIR (6b), T1 com supressão de gordura pós-contraste venoso (6c) e T1 em fase (6d) e fora de fase (6e).

Figura 7 (a-b): Imagens de RM do ombro no plano transversal nas ponderações T1 em fase (7a) e fora de fase (7b). Sinal da lesão na sequência em fase (EF) de 1063 e na sequência fora de fase (FF) de 747.

Figura 8 (a-d): Imagens de RM do ombro no plano transversal na ponderação DP com supressão de gordura (8a), T1 com supressão de gordura pós-contraste (8b), difusão com b1000 (8c) e ADC (valor = 1533) (4d). Gd - gadolínio.

Figura 9: Imagem de RM do ombro no plano sagital na ponderação T1 com supressão de gordura pós-contraste. Gd - gadolínio.
Descrição dos achados

Figura 1 (a-e)’: Imagens de RM do ombro no plano coronal mostrando lesão no acrômio (setas amarelas) com baixo sinal na ponderação T1 (1a’), e alto sinal em T2 (1b’) e T2 com supressão de gordura (1c’). Nas sequências T1 em fase (1d’) e fora de fase (1e’) não houve queda do sinal da lesão (relação em fase / fora de fase = 0).


Figura 2 (a-c)’: Imagens de RM do ombro no plano transversal na ponderação T1 com supressão de gordura antes (2a’) e após a administração venosa de contraste (2b’), demonstrando que a lesão apresenta alto sinal em ambas (setas amarelas). Com subtração das sequências (2c’) fica evidente que realmente houve realce pelo contraste (seta branca). Gd - gadolínio.


Figura 3 (a-b)’: Imagens de RM do ombro no plano sagital na ponderação DP com supressão de gordura (3a’) e T1 com supressão de gordura pós-contraste (3b’) mostrando a localização da lesão na porção mais anterior do acrômio (setas amarelas). Note que também há realce pelo contraste nas partes moles adjacentes (seta laranja), o que não tem muita expressão na sequência DP. Gd - gadolínio.

Figura 4 (a-d)’: Imagens de RM do ombro no plano transversal na ponderação DP com supressão de gordura (4a’), mostrando a lesão na porção anterior do acrômio (seta amarela), que apresenta sinal intermediário no mapa ADC (seta azul), onde foi obtido valor de 805 (4b’). A lesão apresenta hipersinal na difusão (setas azul claro), tanto no b100 (4c’) quanto no b1000 (4d’).

Figura 5 (a-b)’: Imagens de PET-CT FDG nos planos coronal (5a) e transversal (5b), mostrando o acúmulo do traçador na lesão no acrômio (setas vermelhas). A lesão não apresenta muita expressão na aquisição tomográfica (seta branca).
No exame de controle 5 meses depois do tratamento radioterápico observamos que:

Figura 6 (a-e)’: Ainda é possível observar a lesão (setas amarelas) nas imagens de RM do ombro no plano coronal nas ponderações T2 (6a’) e STIR (6b’), assim como o realce pelo contraste (seta vermelha) em T1 com supressão de gordura (6c’). Visualmente, há aparente redução do sinal da lesão (setas verdes) na sequência fora de fase (6e’) em comparação com a sequência T1 em fase (6d’).
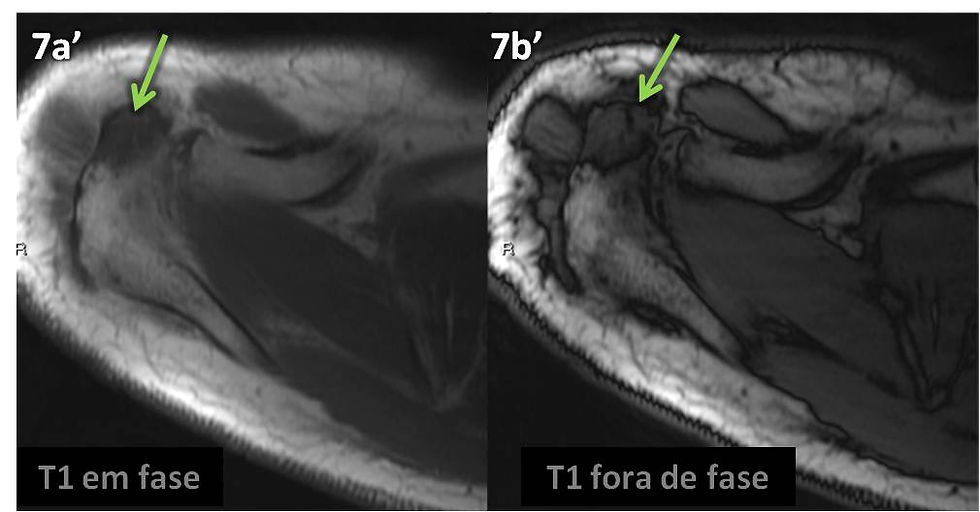
Figura 7 (a-b)’: Imagens de RM do ombro no plano transversal nas ponderações T1 em fase (7a’) e fora de fase (7b’), onde a lesão (setas verdes) apresenta relação entre as sequências FF/EF de 0,7 (747 / 1063), o que equivale a queda de 30% do sinal.

Figura 8 (a-d)’: Imagens de RM do ombro no plano transversal na ponderação DP com supressão de gordura (8a’) mostrando que a lesão ainda é visível (seta amarela) e apresenta realce pelo contraste (seta vermelha) em T1 com supressão de gordura (8b’). O hipersinal na difusão difusão com b1000 (8c’) é mais discreto (seta azul claro) e no ADC a lesão (seta azul) apresenta agora valor de 1533 (4d’). Gd - gadolínio.

Figura 9’: Imagem de RM do ombro no plano sagital na ponderação T1 com supressão de gordura pós-contraste mostrando o realce pelo contraste na lesão (seta amarela). Gd - gadolínio.
Discussão
As metástases ósseas correspondem a 70% dos tumores malignos do adulto e os sítios primários mais comuns, responsáveis por 80% dos casos, são os tumores de próstata, mama, pulmão e carcinoma de células renais. A distribuição das metástases ósseas segue o padrão de distribuição da medula vermelha, provavelmente um reflexo do maior fluxo sanguíneo em comparação com a medula amarela. Portanto, os locais mais frequentes são as vértebras, bacia, fêmur e úmero proximal e calota craniana. A maioria dos casos de metástase óssea é assintomática. Quando provoca sintomas, os mais comuns são dor local, fratura patológica, deformidade e sintomas decorrentes da compressão das estruturas adjacentes, principalmente quando há massa de partes moles associada.
O tumor de próstata é a neoplasia mais comum nos homens acima de 50 anos, sendo o adenocarcinoma o tipo mais frequente (95% dos casos). A principal via de disseminação é a hematogênica, embora possa ocorrer também disseminação linfática através de linfonodos para-aórticos para o osso. Os locais mais comuns das metástases hematogênicas do tumor da próstata são o osso (90% casos), pulmão (45%), fígado (25%), pleura (20%) e adrenais (15%).
O paradigma atual para os pacientes com carcinoma de próstata recém-diagnosticado é a estratificação de risco. O PSA (antígeno prostático específico; valor normal de referência de 1 a 4 ng/dL), embora seja um biomarcador utilizado nos exames de screening e no monitoramento dos pacientes com carcinoma prostático, não é um bom indicador de progressão da doença, de sobrevida ou da necessidade de mudança no tratamento. Além disso, o PSA é de pouco valor para predizer metástases ósseas nos casos de tumores pouco diferenciados e quando o paciente está em uso de terapia hormonal, pois a expressão do PSA é diretamente influenciada pelo status androgênico e pacientes com níveis normais ou baixos de PSA podem ter evidência de progressão metastática. Por isso, os métodos de imagem foram incluídos nos guidelines de avaliação dos pacientes com tumor da próstata, com diversos esforços para a padronização da aquisição das imagens e confecção dos relatórios, como o Prostate Imaging Reporting and Data System (PI-RADS) (quadro 1).

Quadro 1: Estratificação de risco de carcinoma prostático em 5 categorias de acordo com o PIRADS. Para mais detalhes das características de cada categoria acesso ao documento completo em PDF pelo link: https://www.acr.org/-/media/ACR/Files/RADS/PI-RADS/PIRADS-V2-1.pdf
Com o maior esclarecimento da população e realização rotineira de exames de screeaning, o número de casos de adenocarcinoma diagnosticados precocemente tem aumentado. E a crescente realização de exames de RM da próstata em pacientes com risco baixo ou intermediário acarretou a detecção de diversas alterações ósseas sem significado relevante.
No estudo de Vargas et al., onde foram analisados 3765 exames de RM da próstata de pacientes com diagnóstico recente de adenocarcinoma, enquanto que a presença de alterações ósseas foi bem frequente (em cerca de 70% das RM), as metástases foram encontradas em menos de 2% dos casos, que mantiveram correlação com os critérios da National Comprehensive Cancer Network (NCCN): nenhum paciente de baixo risco (Gleason < 7; PSA < 10 ng/ml; cT12a) apresentou metástases ósseas, encontradas apenas em pacientes com score de Gleason e valores de PSA maiores. Por esse motivo, a pesquisa de metástases ósseas em pacientes assintomáticos com carcinoma prostático bem ou moderadamente diferenciado recém-diagnosticado e com valores de PSA < 20 ng/mL não é realizada de rotina, embora seja recomendada a pesquisa de lesões ósseas suspeitas na bacia e coluna lombar na avaliação da RM da próstata. Já para os tumores não-diferenciados a pesquisa de metástases ósseas com estudo específico é indicada, independentemente do valor do PSA.
Briganti et al. em 2010 descreveram uma estratificação de risco para selecionar os pacientes que deveriam realizar exames de imagem na avaliação inicial do carcinoma de próstata (quadro 2):

Quadro 2: Estratificação de risco para metástase óssea segundo Briganti et al. (2010) usando como critérios o escore de Gleason, a classificação TNM e o PSA para estimar o risco de metástases.
A cintilografia óssea com tecnécio (99mTc) passou então a ser o método de escolha para a pesquisa de metástases ósseas em pacientes com PSA ≥ 20 ng/ml e escore de Gleason ≥ 8 conforme diversos guidelines. Segundo diversas meta-análises, a cintilografia óssea apresenta sensibilidade de 70-79% e especificidade de 82% na detecção de metástases ósseas tendo como base a avaliação por paciente e sensibilidade de 59% e especificidade de 75% usando como base a detecção por lesão. A cintilografia óssea não visualiza diretamente a metástase, mas sim a reação osteoblástica pela presença de células tumorais e sua detecção tem correlação com os valores de PSA (Quadro 3).

Quadro 3: Percentual de detecção de metástases ósseas pela cintilografia com tecnécio de acordo com os valores de PSA.
A tomografia computadorizada (TC) apresenta sensibilidade de 56% e especificidade de 74% na detecção das metástases ósseas, sendo que a associação da cintilografia com a TC de baixa dose (SPECT-CT - single-photon emission computed tomography (SPECT) associado à TC) aumentou a sensibilidade na detecção das metástases ósseas em pacientes com carcinoma de próstata para 87–92%.
Devido aos custos, disponibilidade e tempo de exame, a maioria dos guidelines recomenda a avaliação inicial de metástases através de radiografias, TC e cintilografia óssea. Entretanto, nos últimos anos surgiram métodos mais avançados que se mostraram superiores à cintilografia, embora ainda não estejam presentes nos guidelines oficiais.
O PET/CT usando 18F-Fluordeoxiglicose (FDG) aumentou drasticamente a detecção de metástases ósseas, inclusive das lesões ainda não identificáveis nos estudos radiológicos anatômicos, com sensibilidade superior a 90–95% e especificidade de 92-99%, com alguns estudos demonstrando sensibilidade e especificidade de até 100%. O PET/CT usando 11C-colina apresenta sensibilidade de 91% e especificidade de 99%, e consegue distinguir entre as lesões malignas e as alterações degenerativas devido a estas últimas não serem ávidas pela colina. Entretanto, é importante salientar que a colina pode se acumular em lesões ósseas decorrentes de trauma recente.
A RM também se mostrou superior à cintilografia, conforme visto no quadro 4 onde estão resumidas a sensibilidade e especificidade dos diversos métodos na detecção das metástases ósseas.

Quadro 4: Sensibilidade e especificidade dos diversos métodos na detecção de metástases ósseas. Modificado de Turpin A e cols. Imaging for Metastasis in Prostate Cancer: A Review of the Literature. Front Oncol. 2020 Jan 31;10:55.
Nos últimos anos a RM de corpo inteiro também demonstrou ter alta acurácia na pesquisa de metástases ósseas, embora o PCWG (Prostate Cancer Clinical Trials Working Group) ainda recomende a realização de cintilografia e TC.
O MET-RADS-P (METastasis Reporting and Data System for Prostate Cancer) foi criado para promover uma padronização, reduzindo as variações na aquisição, interpretação e forma de informar as alterações nos exames de RM do corpo inteiro em pacientes com doença avançada, levando em conta que, embora tenha resolução espacial inferior, a RM de corpo inteiro apresenta alto contraste entre as lesões suspeitas e o osso quando comparada com a TC. Além disso, a RM de corpo inteiro consegue claramente categorizar a resposta ao tratamento (incluindo a detecção de resistência primária e secundária e heterogeneidade de resposta), ajudando na estratégia terapêutica, enquanto a cintilografia e o PET-CT apenas identificam a progressão da doença.
As regiões de acometimento dos tumores prostáticos sinalizadas no laudo estruturado proposto pelo MET-RADS-P estão listadas no quadro 5:

Quadro 5: Regiões de acometimento dos tumores prostáticos segundo MET-RADS. Para maiores detalhes veja a versão completa no link:
A doença metastática pode levar a perda óssea ou formação óssea em graus variáveis. A perda óssea ocorre devido à ativação osteoclástica e destruição enzimática, manifestando-se como lesões líticas. A formação óssea pode ocorrer no interior do substrato tumoral (como no caso das metástases do carcinoma da próstata) ou como formação reativa de osso novo em resposta ao tumor adjacente, semelhante ao que ocorre na formação do calo ósseo, ambas se manifestando como lesões blásticas. Entretanto, nem sempre as metástases se manifestam apenas nas formas lítica ou blástica. Na verdade, há um espectro de formas de apresentação que varia desde o exame tomográfico normal até aspectos mistos ou em vidro fosco. Padhani descreveu 7 padrões de metástases ósseas, conforme pode ser visto na figura 10, retirada de sua palestra ‘Multiparametric imaging of bone marrow metastatic disease’ disponível no YouTube no link - https://www.youtube.com/watch?v=EWpqW9xAm4A.

Figura 10: Formas de apresentação das metástases ósseas segundo Anwar Padhani. https://www.youtube.com/watch?v=EWpqW9xAm4A.
Esses diferentes padrões refletem a ativação e formação osteoclástica reguladas pelo sistema RANKL/RANK/OPG, descoberto na década de 90. A proteína RANKL (ligante do receptor ativador do fator nuclear kappa B) e os seus dois receptores RANK (receptor ativador do fator nuclear kappa B, localizado na superfície dos osteoclastos e seus precursores) e OPG (osteoprotegerina, secretada pelos osteoblastos e células tronco osteogênicas) apresentam papéis fundamentais na biologia dos osteoclastos. A interação RANKL/RANK é essencial para a estimulação da osteoclastogênese e promoção da reabsorção óssea. Já a interação RANKL/OPG inibe a estimulação dos osteoclastos, protegendo o osso da reabsorção excessiva ao se ligar ao RANKL, impedindo sua ligação com o RANK (figura 11).

Figura 11: Representação esquemática da regulação óssea normal através do sistema RANKL/RANK/OPG. O receptor RANK promove a osteólise, enquanto que o OPG promove a atividade osteoblástica.
O carcinoma prostático costuma se apresentar como lesões mistas na TC e cintilografia e com alta celularidade na RM ou osteoblásticas na TC e cintilografia e escleróticas/hipocelulares, com calcificação central ou com halo de hipersinal em T2 com supressão de gordura na RM. No quadro 6 estão resumidas as diversas formas de apresentação mais comuns de metástases ósseas segundo Padhani.

Quadro 6: Diversas formas de apresentação das metástases ósseas mais comuns de acordo com o aspecto na TC, positividade na cintilografia e celularidade na RM. CTM – células tronco mesenquimais (mesenchymal stem cell).
Conforme visto no cado do mês de janeiro/21 (MIELODISPLASIA E FRATURA DO CORPO VERTEBRAL) no quadro que sita as categorias dos diversos tipos de desordens da medula óssea, a metástase é considerada um tipo de infiltração medular, onde os componentes normais da medula são substituídos pelas células metastáticas.
Na RM, a substituição dos elementos normais da medula óssea pela lesão tumoral se manifesta como área de sinal hipointenso na ponderação T1. Na ponderação T2 as lesões metastáticas se apresentam com sinal mais hiperintenso que a medula óssea normal pelo seu alto conteúdo de água. As lesões metastáticas costumam ter realce pelo meio de contraste, embora a administração de gadolínio não consiga diferenciar completamente as lesões ósseas benignas das malignas, sendo mais útil na avaliação dos componentes de partes moles.
A mensuração das lesões deve ser realizada na ponderação T1 com alta resolução. O limite preconizado é medir até 5 lesões ≥ 1,0 cm na TC e ≥ 1,5 cm no maior diâmetro na RM do corpo inteiro, sendo pelo menos uma no esqueleto axial, se houver. Isso porque a resolução espacial da RM do corpo inteiro é inferior à da TC. Mas, caso sejam utilizadas sequências com alta resolução espacial na RM, o limite pode ser ≥ 1,0 cm. Todas as lesões devem ser reportadas, mesmo as imensuráveis.
Para a avaliação das lesões ósseas é necessária a realização da difusão com pelo menos dois valores de b para que seja possível o cálculo do ADC, sendo preconizado na maioria dos protocolos a difusão com b0, b entre 50 e 100 e b entre 800 e 1000 (b alto). Para evitarmos resultados falso-positivos, as imagens de difusão devem ser correlacionadas com as imagens nas ponderações T1 FSE (fast spin echo), T1 GRE (gradient-recalled echo) em fase e fora de fase e os valores de ADC. Na medula óssea normal é esperada uma queda do sinal > 20% na sequência fora de fase devido ao fato da medula óssea no adulto apresentar cerca de 40 a 50% de gordura. Nos casos em que a queda é < 20% isso reflete que há substituição da gordura normal da medula óssea por outro tipo de celularidade, situação que ocorre nas lesões suspeitas.
Os valores normais da medula óssea, das lesões tumorais em atividade e das lesões após resposta ao tratamento estão resumidas no quadro 7.

Quadro 7: Valores normais de ADC na medula óssea normal, no caso dos tumores viáveis e na doença tratada.
No gráfico abaixo estão representados os valores de ADC relacionados à doença em atividade e com resposta ao tratamento: a medula óssea normal apresenta ADC < 600, sendo que a medula óssea amarela costuma ter sinal na difusão e valores de ADC inferiores aos da medula vermelha devido ao seu conteúdo adiposo. A medula óssea vermelha hiperplásica, com infiltração tumoral moderada e infiltração tumoral densa com alta celularidade apresentam valores de ADC intermediários, entre 600-700 a 1400-1500. No caso de tumores com boa resposta ao tratamento nota-se inicialmente um aumento nos valores de ADC, que ultrapassam o valor de 1400-1500, principalmente devido à necrose tumoral, e com o tempo esses valores podem decair aos valores da medula óssea normal pela rehabitação com gordura e células hematopoiéticas normais. Quando não há resposta efetiva ao tratamento os valores de ADC permanecem na faixa de 600-1400 indicando alta celularidade.

Gráfico 1: Representação esquemática no gráfico ADC x sinal na difusão (b 800-1000) da medula óssea amarela e vermelha, medula óssea hiperplásica e células tumorais em atividade, mostrando que as lesões tumorais com alta celularidade encontram-se na faixa intermediária de ADC entre 600-650 e 1400-1500.
No caso deste mês, embora a lesão no acrômio ainda seja detectada e exista realce pelo meio de contraste, podemos afirmar que houve boa resposta à radioterapia: o hipersinal na difusão reduziu, o valor de ADC aumentou de 805 (faixa de ADC intermediário, indicando alta celularidade/lesão em atividade) para 1533 (faixa de resposta ao tratamento) e foi identificada queda do sinal em torno de 30% na sequência T1 fora de fase, indicando surgimento de conteúdo gorduroso no local da lesão.
A medida dos valores de ADC só deve ser aferida nas metástases com água detectável na difusão, devendo ser examinadas em todos os valores de b (caso a metástase não seja hiperintensa na difusão com b800-1000, o ADC ainda assim pode ser aferido caso a lesão seja hiperintensa nos demais valores de b – baixo ou intermediário). Nas metástases que não são hiperintensas em nenhum valor de b, como as lesões escleróticas densas, os valores de ADC serão errôneos, refletindo apenas o ruído da imagem.
Deve ser ressaltado que nem toda metástase apresenta hipersinal na difusão com b800-1000. Isso pode ocorrer nos casos de infiltração tumoral com celularidade mais esparsa, com matriz densa de mineralização (de-novo ou relacionada ao uso de bifosfonado/denosumab), quando há necrose significativa (de-novo ou após terapia) ou no caso das lesões tratadas. As metástases também podem ser obscurecidas quando há infiltração ou hiperplasia difusa da medula óssea, como no caso do uso de fatores estimulantes do crescimento.
A resposta ao tratamento nas metástases ósseas foram categorizadas em 5 grupos pelo MET-RADS-P, sumarizados no quadro 8:

Quadro 8: Resposta ao tratamento nas metástases ósseas categorizadas pelo MET-RADS-P. Modificado de Padhani AR, et al. METastasis Reporting and Data System for Prostate Cancer: Practical Guidelines for Acquisition, Interpretation, and Reporting of Whole-body Magnetic Resonance Imaging-based Evaluations of Multiorgan Involvement in Advanced Prostate Cancer. EUROPEAN UROLOGY 71 (2017) 81–92.
Os diagnósticos diferenciais mais comuns das metástases osteolíticas incluem o cisto ósseo aneurismático, outros tumores primários do osso e malformações vasculares atípicas. Já no caso das metástases blásticas devem ser consideradas no diagnóstico diferencial as alterações relacionadas ao tratamento, enostoses e outros tumores ósseos primários, como o osteoblastoma.
Gong XQ, Tao YY, Wang R, Liu N, Huang XH, Zheng J, Yang C, Yang L, Zhang XM. Application of Diffusion Weighted Imaging in Prostate Cancer Bone Metastasis: Detection and Therapy Evaluation. Anticancer Agents Med Chem. 2021 Jan 17. doi: 10.2174/1871520621666210118092641.
Chys B, Devos G, Everaerts W, Albersen M, Moris L, Claessens F, De Meerleer G, Haustermans K, Briganti A, Chlosta P, Gontero P, Graefen M, Gratzke C, Karnes RJ, Kneitz B, Marchioro G, Salas RS, Spahn M, Tombal B, Van Der Poel H, Walz J, Van Poppel H, Joniau S. Preoperative Risk-Stratification of High-Risk Prostate Cancer: A Multicenter Analysis. Front Oncol. 2020 Mar 6;10:246. doi: 10.3389/fonc.2020.00246.
Gauthé M, Zarca K, Aveline C, Lecouvet F, Balogova S, Cussenot O, Talbot JN, Durand-Zaleski I. Comparison of (18)F-sodium fluoride PET/CT, (18)F-fluorocholine PET/CT and diffusion-weighted MRI for the detection of bone metastases in recurrent prostate cancer: a cost-effectiveness analysis in France. BMC Med Imaging. 2020 Mar 2;20(1):25. doi: 10.1186/s12880-020-00425-y.
Turpin A, Girard E, Baillet C, Pasquier D, Olivier J, Villers A, Puech P, Penel N. Imaging for Metastasis in Prostate Cancer: A Review of the Literature. Front Oncol. 2020 Jan 31;10:55. doi: 10.3389/fonc.2020.00055.
Sevcenco S, Grubmüller B, Sonneck-Koenne C, Ahmadi Y, Knoll P, Floth A, Pokieser W, Zandieh S, Christoph Klingler H, Shariat S, Mirzaei S.Bone Scintigraphy in Staging of Newly Diagnosed Prostate Cancer in Regard of Different Risk Groups. Asia Ocean J Nucl Med Biol. 2019 Spring;7(2):149-152. doi: 10.22038/AOJNMB.2019.35768.1242.
Lee K, Park HY, Kim KW, Lee AJ, Yoon MA, Chae EJ, Lee JH, Chung HW. Advances in whole body MRI for musculoskeletal imaging: Diffusion-weighted imaging. J Clin Orthop Trauma. 2019 Jul-Aug;10(4):680-686. doi: 10.1016/j.jcot.2019.05.018.
Vargas HA, et al. Prostate cancer bone metastases on staging prostate MRI: prevalence and clinical features associated with their diagnosis. Abdom Radiol (NY). 2017 January; 42(1): 271–277. doi:10.1007/s00261-016-0851-3. European Urology Volume 71, Issue 1, January 2017, Pages 81-92. doi 10.1016/j.eururo.2016.05.033.
Padhani AR, et al. METastasis Reporting and Data System for Prostate Cancer: Practical Guidelines for Acquisition, Interpretation, and Reporting of Whole-body Magnetic Resonance Imaging-based Evaluations of Multiorgan Involvement in Advanced Prostate Cancer. EUROPEAN UROLOGY 71 (2017) 81–92.
Woo S, et al. JOURNAL CLUB: Identification of Bone Metastasis With Routine Prostate MRI: A Study of Patients With Newly Diagnosed Prostate Cancer. AJR 2016; 206:1156–1163. doi:10.2214/AJR.15.15761.
Joniau S, Briganti A, Gontero P, Gandaglia G, Tosco L, Fieuws S, et al. Stratification of high-risk prostate cancer into prognostic categories: a European multi-institutional study. Eur Urol. (2015) 67:157–64. doi: 10.1016/j.eururo.2014.01.020
Tombal B, Lecouvet F. Modern Detection of Prostate Cancer’s Bone Metastasis: Is the Bone Scan Era Over? Hindawi Publishing Corporation Advances in Urology; 2012, Article ID 893193, pag 1-8, doi:10.1155/2012/893193
Reischauer C, Froehlich JM, Koh DM, Graf N, Padevit C, John H, Binkert CA, Boesiger P, Gutzeit A. Bone metastases from prostate cancer: assessing treatment response by using diffusion-weighted imaging and functional diffusion maps-initial observations. Radiology. 2010 Nov;257(2):523-31. doi: 10.1148/radiol.10092469.
A. Briganti, N. Passoni, M. Ferrari et al. “When to perform bone scan in patients with newly diagnosed prostate cancer: external validation of the currently available guidelines and proposal of a novel risk stratification tool.” European Urology 2010, vol. 57, no. 4, pp. 551–558,.




Comentários